Первый раз на Pharmnews.kz?
Войдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
ЗарегистрироватьсяВойдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
Зарегистрироваться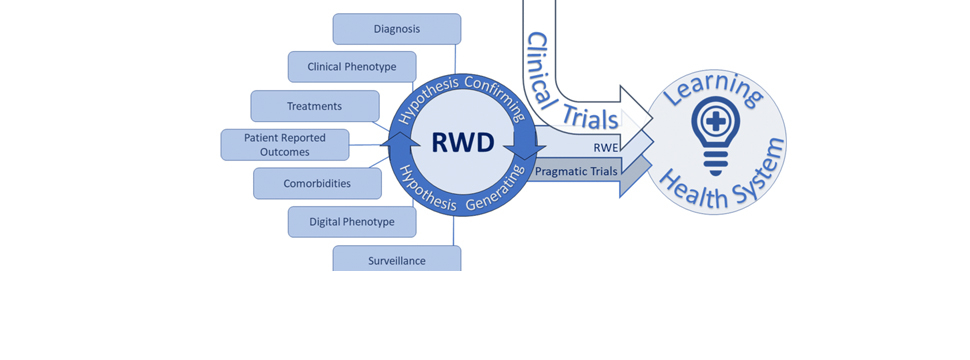
EMA опубликовало третий ежегодный отчет по использованию Real-World Evidence в Европейском Союзе (февраль 2024 — февраль 2025). Этот отчет – часть системной работы Европейского агентства по лекарственным средствам (EMA) по интеграции данных реальной клинической практики (Real-World Data, RWD) в регуляторные решения.
Он подготавливается в рамках стратегии Европейской регуляторной сети (EMRN) до 2028 года и охватывает опыт использования трёх каналов сбора и анализа данных:
DARWIN EU® — координируемая EMA европейская сеть по анализу реальных данных, объединяющая информацию о более чем 180 миллионах пациентов из 16 стран
Framework Contracts (FWC) — механизм оперативного привлечения внешних научных организаций
Внутренние исследования EMA
Что в отчете 2024–2025?
➤ 59 исследований: 33 завершено, 26 в процессе (+47% к прошлому году)
➤ Основные направления: потребление лекарственных препаратов, безопасность, эпидемиология
➤ Средняя длительность исследования в DARWIN EU — 4 месяца
➤ Внедрение новых подходов к ускоренной этической экспертизе и оценке качества данных
Что особенно важно — в отчете приведены конкретные кейсы, в которых RWE сыграло ключевую роль в регуляторных решениях:
➤Исследование риска суицидов у пациентов, принимающих агонисты рецептора глюкагоноподобного пептида 1 (GLP-1), используемые при ожирении и сахарном диабете 2 типа
➤ Мониторинг дефектуры отдельных препаратов
➤ Оценка эффективности и безопасности вакцины против mpox (оспы обезьян), включая пациентов с ВИЧ и иммуносупрессией
➤ Анализ эпидемиологии респираторно-синцитиального вируса (RSV) — для поддержки расширения показаний препарата на возраст 50–59 лет
➤ Применение методов эмуляции таргетных клинических исследований — для оценки онкопрепаратов и вакцин в условиях реальной клинической практики
Отчёт EMA показывает, насколько востребованы данные реальной клинической практики для принятия решений по редким заболеваниям в других странах.

 загружается...
загружается...


 загружается...
загружается...
Комментарии
(0) Скрыть все комментарии