Первый раз на Pharmnews.kz?
Войдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
ЗарегистрироватьсяВойдите, чтобы читать, писать статьи и обсуждать всё, что происходит в мире. А также, чтобы настроить ленту исключительно под себя.
Зарегистрироваться05 декабря 2018
Приказ Министра здравоохранения Республики Казахстан № ҚР ДСМ-34 от 5 декабря 2018 года
Зарегистрирован в Министерстве юстиции Республики Казахстан 6 декабря 2018 года № 17868
О внесении изменений и дополнений в приказ Министра здравоохранения и социального развития Республики Казахстан от 29 мая 2015 года № 416 "Об утверждении регламентов государственных услуг в сфере фармацевтической деятельности"
В соответствии с подпунктом 2) статьи 10 Закона Республики Казахстан от 15 апреля 2013 года "О государственных услугах" ПРИКАЗЫВАЮ:
1. Внести в приказ Министра здравоохранения и социального развития Республики Казахстан от 29 мая 2015 года № 416 "Об утверждении регламентов государственных услуг в сфере фармацевтической деятельности" (зарегистрирован в реестре государственной регистрации нормативных правовых актов Республики Казахстан под № 11484, опубликован 29 июля 2015 года в информационно-правовой системе "Әділет") следующие изменения и дополнения:
пункт 1 изложить в следующей редакции:
"1. Утвердить регламенты государственных услуг:
1) "Выдача согласования и (или) заключения (разрешительного документа) на ввоз (вывоз) зарегистрированных и не зарегистрированных в Республике Казахстан лекарственных средств, изделий медицинского назначения и медицинской техники" согласно приложению 1 к настоящему приказу;
2) "Выдача заключения о безопасности, эффективности и качестве лекарственных средств, изделий медицинского назначения и медицинской техники" согласно приложению 2 к настоящему приказу;
3) "Выдача разрешения на проведение клинического исследования и (или) испытания фармакологических и лекарственных средств, изделий медицинского назначения и медицинской техники" согласно приложению 3 к настоящему приказу;
4) "Государственная регистрация, перерегистрация и внесение изменений в регистрационное досье лекарственного средства, изделия медицинского назначения и медицинской техники" согласно приложению 4 к настоящему приказу;
5) "Выдача решения об утверждении (неутверждении) названий оригинальных лекарственных средств" согласно приложению 5 к настоящему приказу;
6) "Выдача свидетельства о присвоении квалификационной категории специалистам с фармацевтическим образованием" согласно приложению 6 к настоящему приказу;
7) "Выдача сертификата на фармацевтический продукт" согласно 7 к настоящему приказу.";
приложение 2 изложить в новой редакции согласно приложению 1 к настоящему приказу;
дополнить приложением 7 согласно приложения 2 к настоящему приказу;
в регламенте государственной услуги "Выдача согласования и (или) заключения (разрешительного документа) на ввоз (вывоз) зарегистрированных и не зарегистрированных в Республике Казахстан лекарственных средств, изделий медицинского назначения и медицинской техники", утвержденном указанным приказом:
заголовок главы 1 изложить в следующей редакции:
"Глава 1. Общие положения";
пункт 1 изложить в следующей редакции:
"1. Государственная услуга "Выдача согласования и (или) заключения (разрешительного документа) на ввоз (вывоз) зарегистрированных и не зарегистрированных в Республике Казахстан лекарственных средств, изделий медицинского назначения и медицинской техники" (далее – государственная услуга) оказывается Комитетом фармации Министерства здравоохранения Республики Казахстан (далее – Комитет) или его территориальными подразделениями (далее – услугодатель), в том числе через веб-портал "электронного правительства": www.egov.kz или веб-портал "Е-лицензирование": www.elicense.kz.";
заголовок главы 2 изложить в следующей редакции:
"Глава 2. Описание порядка действий структурных подразделений (работников) услугодателя в процессе оказания государственной услуги";
подпункт 1 части первой пункта 5 изложить в следующей редакции:
"1) со дня сдачи документов услугополучателем, а также при обращении на портал со дня сдачи документов услугополучателем на ввоз/вывоз зарегистрированных и незарегистрированных в Республике Казахстан лекарственных средств – 5 (пять) рабочих дней, изделий медицинского назначения и медицинской техники – 5 (пять) рабочих дней;";
заголовок главы 3 изложить в следующей редакции:
"Глава 3. Описание порядка взаимодействия структурных подразделений (работников) услугодателя в процессе оказания государственной услуги";
подпункт 3 пункта 7 изложить в следующей редакции:
"3) специалист услугодателя – 3 рабочих дня на ввоз/вывоз зарегистрированных и незарегистрированных в Республике Казахстан лекарственных средств; 3 рабочих дня на ввоз/ изделий медицинского назначения и медицинской техники.";
Схема бизнес-процесса оказания государственной услуги, с указанием срока выполнения приведено в приложении 1 к настоящему Регламенту.";
Схема бизнес-процесса оказания государственной услуги, с указанием срока выполнения изложить в новой редакции согласно приложению 3 к настоящему приказу.
в регламенте государственной услуги "Выдача разрешения на проведение клинического исследования и (или) испытаний фармакологических и лекарственных средств, изделий медицинского назначения и медицинской техники", утвержденном указанным приказом:
заголовок главы 1 изложить в следующей редакции:
"Глава 1. Общие положения";
пункт 1 изложить в следующей редакции:
"1. Государственная услуга "Выдача разрешения на проведение клинического исследования и (или) испытания фармакологических и лекарственных средств, изделий медицинского назначения и медицинской техники" (далее – государственная услуга) оказывается на основании статьи 74 Кодекса Республики Казахстан от 18 сентября 2009 года "О здоровье народа и системе здравоохранения", а также согласно Стандарту государственной услуги "Выдача разрешения на проведение клинического исследования и (или) испытания фармакологических и лекарственных средств, изделий медицинского назначения и медицинской техники", утвержденному приказом Министра здравоохранения и социального развития Республики Казахстан от 28 апреля 2015 года № 293 (зарегистрирован в Реестре государственной регистрации нормативных правовых актов под № 11338) (далее – Стандарт) Комитетом фармации Министерства здравоохранения Республики Казахстан (далее – услугодатель).";
заголовок главы 2 изложить в следующей редакции:
"Глава 2. Описание порядка действий структурных подразделений (работников) услугодателя в процессе оказания государственной услуги";
пункт 6 изложить в следующей редакции:
"Процедуры (действия) процесса оказания государственной услуги:
процесс 1 – сотрудник канцелярии услугодателя в течение 0,5 (4 часа) рабочего дня со дня поступления документов, проводит регистрацию полученных документов, и передает на рассмотрение руководителю услугодателя, при этом в правом нижнем углу заявления проставляется регистрационный штамп на государственном языке с указанием даты поступления и входящего номера;
процесс 2 – руководитель услугодателя в течение 0,5 (4 часа) рабочего дня со дня поступления документов, рассматривает документы услугополучателя и отписывает заместителю руководителя услугодателя;
процесс 3 – заместитель руководителя услугодателя в течение 0,5 (4 часа) рабочего дня со дня поступления документов, рассматривает документы услугополучателя и отписывает руководителю Управления государственных услуг в сфере фармацевтической деятельности и интеграции (далее – Управление);
процесс 4 – руководитель Управления в течение 1 (одного) рабочего дня со дня получения документов, рассматривает документы услугополучателя на соответствие предъявляемым требованиям и отписывает главному эксперту (эксперту) Управления;
процесс 5 – главный эксперт (эксперт) Управления в течение 3 (трех) рабочих дней со дня получения документов осуществляет рассмотрение документов услугополучателя и подготовит проект приказа, визирует его уполномоченными лицами услугодателя и предоставляет на подпись руководителю услугодателя;
процесс 6 – руководитель Комитета в течение в течение 0,5 (4 часа) рабочего дня рассматривает проект приказа, подписывает и передает главному эксперту (эксперту) Управления;
процесс 7 – главный эксперт (эксперт) Управления в течение 0,5 (4 часа) рабочего дня подписанный приказ регистрирует в журнале регистрации приказов по основной деятельности услугодателя и присвоит номер.";
заголовок главы 3 изложить в следующей редакции:
"Глава 3. Описание порядка взаимодействия структурных подразделений (работников) услугодателя в процессе оказания государственной услуги";
пункт 9 изложить в следующей редакции:
"9. Описание последовательности процедур (действий) между структурными подразделениями (работниками) услугодателя.
Сотрудник канцелярии со дня обращения услугополучателя:
1) проверяет наличие всех представленных документов;
2) регистрирует в журнале регистрации обращений;
3) передает документы руководителю услугодателя.
Руководитель услугодателя и его заместитель в течение рабочего дня, со дня регистрации документа, распределяют поступившие документы, накладывают резолюцию и передают руководителю Управления.
Руководитель управления в течение рабочего дня, со дня регистрации документа, распределяет поступившие документы, накладывает резолюцию и передает главному эксперту (эксперту) Управления.
Главный эксперт (эксперт) Управления:
1) в течение трех рабочих дней, со дня регистрации документов, проверяет полноту и соответствие представленных документов;
2) готовит мотивированный ответ об отказе в случае неполноты и (или) несоответствия представленных документов;
3) в случае положительного решения:
формирует в течение трех рабочих дней проект решения на проведение клинических исследований и (или) испытаний фармакологических и лекарственных средств, изделий медицинского назначения и медицинской техники и передает на согласование и утверждение руководству услугодателя;
4) в случае отрицательного решения:
формирует в течение трех рабочих дней проект решения об отказе в выдаче решения на проведение клинических исследований и (или) испытаний фармакологических и лекарственных средств, изделий медицинского назначения и медицинской техники и передает на согласование и утверждение руководству услугодателя.
Услугодатель письменно информирует услугополучателя о причине приостановления оказания государственной услуги (в срок, не превышающий десяти календарных дней).
Схема бизнес-процесса оказания государственной услуги, с указанием срока выполнения приведено в приложении 1 к настоящему Регламенту.";
Схема бизнес-процесса оказания государственной услуги, с указанием срока выполнения изложить в новой редакции согласно приложению 4 к настоящему приказу.
заголовок главы 4 изложить в следующей редакции:
"Глава 4. Описание порядка использования информационных систем в процессе оказания государственной услуги";
пункт 10 изложить в следующей редакции:
"10. Порядок обращения и последовательность процедур (действий) услугодателя при оказании государственной услуги через Портал:
проверка на Портале подлинности данных о зарегистрированном услугополучателе посредством электронной цифровой подписи (далее – ЭЦП);
выбор пользователем государственной услуги, вывод на экран формы (ввод данных) с учетом ее структуры и форматных требований, прикреплением к форме запроса необходимых документов в электронном виде;
удостоверение (подписание) запроса посредством ЭЦП услугополучателя заполненной формы (введенных данных) запроса оказания государственной услуги;
регистрация электронного документа (запроса услугополучателя) и обработка запроса на Портале;
проверка услугодателем заявления услугополучателя;
получение услугополучателем результата государственной услуги регистрационное удостоверение (дубликат регистрационного удостоверения), сформированного Порталом. Электронный документ формируется с использованием ЭЦП руководителем услугодателя.
При обращении услугополучателя через Портал, результат государственной услуги в срок не более 7 рабочих дней со дня регистрации на Портале представленных документов представленных документов услугополучателя, необходимых для оказания государственной услуги, направляется в личный кабинет в форме электронного документа, удостоверенного ЭЦП.";
в регламенте государственной услуги "Государственная регистрация, перерегистрация и внесение изменений в регистрационное досье лекарственного средства, изделий медицинского назначения и медицинской техники", утвержденном указанным приказом:
заголовок главы 1 изложить в следующей редакции:
"Глава 1. Общие положения";
пункт 1 изложить в следующей редакции:
"1. Государственная услуга "Государственная регистрация, перерегистрация и внесение изменений в регистрационное досье лекарственного средства, изделий медицинского назначения и медицинской техники" (далее – государственная услуга) оказывается на основании статьи 71 Кодекса Республики Казахстан от 18 сентября 2009 года "О здоровье народа системе здравоохранения", а также согласно Стандарту государственной услуги "Государственная регистрация, перерегистрация и внесение изменений в регистрационное досье лекарственного средства, изделий медицинского назначения и медицинской техники", утвержденному приказом Министра здравоохранения и социального развития Республики Казахстан от 28 апреля 2015 года № 293 (зарегистрирован в Реестре государственной регистрации нормативных правовых актов за № 11338) (далее – Стандарт) Комитетом фармации Министерства здравоохранения Республики Казахстан (далее – услугодатель).";
заголовок главы 2 изложить в следующей редакции:
"Глава 2. Описание порядка действий структурных подразделений (работников) услугодателя в процессе оказания государственной услуги";
пункт 6 изложить в следующей редакции:
"6. Процедуры (действия) процесса оказания государственной услуги:
процесс 1 – сотрудник канцелярии услугодателя в течение 0,5 (4 часа) рабочего дня со дня поступления документов, проводит регистрацию полученных документов, и передает на рассмотрение руководителю услугодателя, при этом в правом нижнем углу заявления проставляется регистрационный штамп на государственном языке с указанием даты поступления и входящего номера;
процесс 2 – руководитель услугодателя в течение 0,5 (4 часа) рабочего дня со дня поступления документов, рассматривает документы услугополучателя и отписывает заместителю руководителя услугодателя;
процесс 3 – заместитель руководителя услугодателя в течение 0,5 (4 часа) рабочего дня со дня поступления документов, рассматривает документы услугополучателя и отписывает руководителю Управления государственных услуг в сфере фармацевтической деятельности и интеграции (далее – Управление);
процесс 4 – руководитель Управления в течение 1 (одного) рабочего дня со дня получения документов, рассматривает документы услугополучателя на соответствие предъявляемым требованиям и отписывает главному эксперту (эксперту) Управления;
процесс 5 – главный эксперт (эксперт) Управления в течение 3 (трех) рабочих дней со дня получения документов осуществляет рассмотрение документов услугополучателя и подготовит проект приказа, визирует его уполномоченными лицами услугодателя и предоставляет на подпись руководителю услугодателя;
процесс 6 – руководитель Комитета в течение в течение 0,5 (4 часа) рабочего дня рассматривает проект приказа, подписывает и передает главному эксперту (эксперту) Управления;
процесс 7 – главный эксперт (эксперт) Управления в течение 0,5 (4 часа) рабочего дня подписанный приказ регистрирует в журнале регистрации приказов по основной деятельности услугодателя и присвоит номер.";
заголовок главы 3 изложить в следующей редакции:
"Глава 3. Описание порядка взаимодействия структурных подразделений (работников) услугодателя в процессе оказания государственной услуги";
пункт 9 изложить в следующей редакции:
"9. Описание последовательности процедур (действий) между структурными подразделениями (работниками) услугодателя.
Сотрудник канцелярии со дня обращения услугополучателя:
1) проверяет наличие всех представленных документов;
2) регистрирует в журнале регистрации обращений;
3) передает документы руководителю услугодателя.
Руководитель услугодателя и его заместитель в течение рабочего дня, со дня регистрации документа, распределяют поступившие документы, накладывают резолюцию и передают руководителю Управления.
Руководитель управления в течение рабочего дня, со дня регистрации документа, распределяет поступившие документы, накладывает резолюцию и передает главному эксперту (эксперту) Управления.
Главный эксперт (эксперт) Управления:
1) в течение трех рабочих дней, со дня регистрации документов, проверяет полноту и соответствие представленных документов;
2) готовит мотивированный ответ об отказе в случае неполноты и (или) несоответствия представленных документов;
3) в случае положительного решения:
формирует в течение трех рабочих дней проект решения на государственную регистрацию, перерегистрацию, внесение изменений в регистрационное досье лекарственного средства, изделий медицинского назначения и медицинской техники и передает на согласование и утверждение руководству услугодателя;
4) в случае отрицательного решения:
формирует в течение трех рабочих дней проект решения об отказе в государственной регистрации, перерегистрации и во внесении изменений в регистрационное досье лекарственного средства, изделий медицинского назначения и медицинской техники и передает на согласование и утверждение руководству услугодателя.
Услугодатель письменно информирует услугополучателя о причине приостановления оказания государственной услуги (в срок, не превышающий десяти календарных дней).
Схема бизнес-процесса оказания государственной услуги, с указанием срока выполнения приведено в приложении 1 к настоящему Регламенту.";
Схема бизнес-процесса оказания государственной услуги, с указанием срока выполнения изложить в новой редакции согласно приложению 5 к настоящему приказу.
заголовок главы 4 изложить в следующей редакции:
"Глава 4. Описание порядка использования информационных систем в процессе оказания государственной услуги";
часть 2 пункта 10 изложить в следующей редакции:
"При обращении услугополучателя через Портал, результат государственной услуги в срок не более 7 рабочих дней со дня регистрации на Портале представленных документов представленных документов услугополучателя, необходимых для оказания государственной услуги, направляется в личный кабинет в форме электронного документа, удостоверенного ЭЦП.";
В регламенте государственной услуги "Выдача решения об утверждении (не утверждении) названий оригинальных лекарственных средств", утвержденном указанным приказом:
заголовок главы 1 изложить в следующей редакции:
"Глава 1. Общие положения";
пункт 1 изложить в следующей редакции:
"1. Государственная услуга "Выдача решения об утверждении (не утверждении) названий оригинальных лекарственных средств" (далее – государственная услуга) и оказывается на основании статьи 70 Кодекса Республики Казахстан от 18 сентября 2009 года "О здоровье народа системе здравоохранения", а также согласно Стандарту государственной услуги "Выдача решения об утверждении (не утверждении) названий оригинальных лекарственных средств", утвержденному приказом Министра здравоохранения и социального развития Республики Казахстан от 28 апреля 2015 года № 293 (зарегистрирован в Реестре государственной регистрации нормативных правовых актов под № 11338) (далее – Стандарт) Комитетом фармации Министерства здравоохранения Республики Казахстан (далее – услугодатель).";
заголовок главы 2 изложить в следующей редакции:
"Глава 2. Описание порядка действий структурных подразделений (работников) услугодателя в процессе оказания государственной услуги";
заголовок главы 3 изложить в следующей редакции:
"Глава 3. Описание порядка взаимодействия структурных подразделений (работников) услугодателя в процессе оказания государственной услуги";
в регламенте государственной услуги "Выдача свидетельства о присвоении квалификационной категории специалистам с фармацевтическим образованием", утвержденном указанным приказом:
пункт 1 изложить в следующей редакции:
"1. Государственная услуга "Выдача свидетельства о присвоении квалификационной категории специалистам с фармацевтическим образованием" (далее – государственная услуга) оказывается территориальными департаментами Комитета фармации Министерства здравоохранения Республики Казахстан (далее – услугодатель) в соответствии со Стандартом государственной услуги "Выдача свидетельства о присвоении квалификационной категории специалистам с фармацевтическим образованием", утвержденным приказом Министра здравоохранения и социального развития Республики Казахстан от 28 апреля 2015 года № 293 (зарегистрирован в Реестре государственной регистрации нормативных правовых актов за № 11338) (далее – Стандарт).
Прием заявления на получение государственной услуги осуществляются через веб-портал "электронного правительства" www.egov.kz, www.elicense.kz (далее – портал).
Выдача результата оказания государственной услуги осуществляется через портал.".
2. Комитету фармации Министерства здравоохранения Республики Казахстан в установленном законодательством Республики Казахстан порядке обеспечить:
1) государственную регистрацию настоящего приказа в Министерстве юстиции Республики Казахстан;
2) в течение десяти календарных дней со дня государственной регистрации настоящего приказа направление его копии в бумажном и электронном виде на казахском и русском языках в Республиканское государственное предприятие на праве хозяйственного ведения "Республиканский центр правовой информации" для официального опубликования и включения в Эталонный контрольный банк нормативных правовых актов Республики Казахстан;
3) в течение десяти календарных дней после государственной регистрации настоящего приказа направление его копии на официальное опубликование в периодические печатные издания;
4) размещение настоящего приказа на интернет-ресурсе Министерства здравоохранения Республики Казахстан после его официального опубликования;
5) в течение десяти рабочих дней после государственной регистрации настоящего приказа в Департамент юридической службы Министерства здравоохранения Республики Казахстан сведений об исполнении мероприятий, предусмотренных подпунктами 1), 2), 3) и 4) настоящего пункта.
3. Контроль за исполнением настоящего приказа возложить на вице-министра здравоохранения Республики Казахстан Цой А.В.
4. Настоящий приказ вводится в действие по истечении десяти календарных дней после дня его первого официального опубликования.
|
Министр здравоохранения Республики Казахстан |
Е. Биртанов |
|
|
Приложение 1 |
|
|
Приложение 2 |
Регламент государственной услуги "Выдача заключения о безопасности, эффективности и качестве лекарственных средств, изделий медицинского назначения и медицинской техники"
Глава 1. Общие положения
1. Государственная услуга – "Выдача заключения о безопасности, эффективности и качестве лекарственных средств, изделий медицинского назначения и медицинской техники" (далее – государственная услуга) оказывается Республиканским государственным предприятием на праве хозяйственного ведения "Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники" Министерства здравоохранения Республики Казахстан (далее – услугодатель).
Государственная услуга оказывается на основании Стандарта государственной услуги "Об утверждении стандартов государственных услуг в сфере фармацевтической деятельности", утвержденного приказом Министра здравоохранения и социального развития Республики Казахстан от 28 апреля 2015 года № 293 (зарегистрирован в Реестре государственной регистрации нормативных правовых актов под № 11338) (далее – Стандарт).
2. Форма оказания государственной услуги – бумажная.
В случае, если услугополучатель предоставляет документы и материалы (за исключением образцов лекарственных средств и изделий медицинского назначения) через информационную систему услугодателя (далее – информационная система), форма взаимодействия – электронная (частично автоматизированная).
Услугополучатель имеет возможность получения информации о порядке и статусе оказания государственной услуги в режиме удаленного доступа посредством "личного кабинета" на официальном сайте услугодателя www.dari.kz.
3. Результатом оказания государственной услуги является заключение о безопасности, эффективности и качестве лекарственных средств, изделий медицинского назначения и медицинской техники с рекомендацией о возможности или невозможности государственной регистрации, перерегистрации, внесении изменений в регистрационное досье (далее – заключение).
Мотивированный ответ в отказе оказания государственной услуги осуществляется в случаях и по основаниям, предусмотренным пунктом 10 Стандарта.
4. Форма предоставления результата оказания государственной услуги: бумажная.
Глава 2. Описание порядка действий структурных подразделений (работников) услугодателя в процессе оказания государственной услуги
5. Основанием для начала процедуры (действия) по оказанию государственной услуги является подача услугополучателем и прием услугодателем заявления, документов и материалов, предусмотренных пунктом 9 Стандарта.
Подтверждением принятия заявления на бумажном носителе является отметка на его копии о регистрации в Центр по обслуживанию заявителей услугодателя (далее - ЦОЗ) с указанием даты и времени приема пакета документов и материалов.
6. Содержание каждой процедуры (действия) одного заявления, входящей в состав процесса оказания государственной услуги, длительность ее выполнения:
1) прием заявления, документов и образцов лекарственных средств или изделий медицинского назначения (далее - материалы), представленных услугополучателем (либо его представителем по доверенности) по акту приема-передачи, а также проверка наличия полного пакета документов согласно перечню, предусмотренному Стандартом, материалов регистрационного досье, согласно Правилам экспертизы, и ввод информации по представленным для экспертизы материалам в информационную систему услугодателя (далее – информационная система) осуществляется ответственным работником ЦОЗ в течение 30 минут.
В случае представления услугополучателем неполного пакета документов и (или) документов с истекшим сроком действия услугодатель отказывает в приеме заявления.
2) рассмотрение материалов, поступивших через информационную систему, определение ответственного работника и передача на исполнение осуществляется руководителями структурных подразделений услугодателя, ответственными за проведение экспертных работ в течение 1 (одного) календарного дня с учетом сроков, установленных пунктом 4 Cтандарта;
3) проведение экспертизы поступивших материалов, ввод результатов экспертизы и подготовка заключений по результатам каждого из этапов экспертизы, а также подготовка заключений по результатам оказания государственной услуги и сопроводительного письма услугополучателю осуществляется работниками структурных подразделений услугодателя, ответственными за проведение экспертных работ, в информационной системе в течение сроков, установленных пунктом 4 cтандарта.
При необходимости на любом из этапов экспертизы при оказании государственной услуги услугодатель запрашивает у услугополучателя разъяснения или уточнения положений в представленных документах. Переписка осуществляется через ЦОЗ путем формирования электронного документа через информационную систему или на бумажных носителях;
4) формирование результата оказания государственной услуги согласно Приложениям 1, 2, 3, 4 Стандарта осуществляется ответственными работниками структурных подразделений услугодателя в сроки, предусмотренные пунктом 4 Стандарта и включает:
- формирование проектов сопроводительного письма и заключения на государственном и русском языках;
- согласование проекта заключения по результатам оказания государственной услуги и сопроводительного письма руководителем ответственного структурного подразделения услугодателя;
- распечатка согласованных проектов сопроводительного письма и заключения из информационной системы;
5) подписание сопроводительного письма и заключения результата оказания государственной услуги осуществляется руководством услугодателя на бумажном носителе в течение 1 (одного) календарного дня с учетом сроков, установленных пунктом 4 настоящего регламента;
6) регистрация результата оказания государственной услуги с сопроводительным письмом осуществляется ЦОЗ в течение 1 (одного) календарного дня с учетом сроков, установленных пунктом 4 настоящего регламента;
7) выдача результата оказания государственной услуги с сопроводительным письмом услугополучателю осуществляется через ЦОЗ в течение 30 минут с момента обращения услугополучателя.
7. Если услугополучатель не обратился за результатом оказания государственной услуги, то услугодатель обеспечивает хранение результата оказания государственной услуги в срок не более 180 дней с момента его регистрации в информационной системе.
Глава 3. Описание порядка взаимодействия структурных подразделений (работников) услугодателя в процессе оказания государственной услуги
8. Описание последовательности процедур (действий) с указанием длительности каждой процедуры (действия) изложено согласно приложению 1 к настоящему регламенту государственной услуги.
9. В процессе оказания государственной услуги участвуют следующие структурные подразделения (работники) услугодателя:
1) ЦОЗ;
2) структурные подразделения услугодателя, осуществляющие экспертизу;
3) руководство услугодателя.
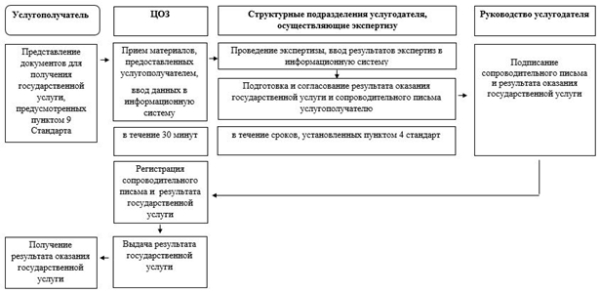
10. ЦОЗ осуществляет прием материалов, необходимых для оказания государственной услуги:
Ответственный сотрудник ЦОЗ вводит заявление с прилагаемыми документами в информационную систему для доступа к материалам структурных подразделений услугодателя в целях проведения экспертизы при государственной регистрации, перерегистрации и внесения изменений в регистрационное досье лекарственных средств, изделий медицинского назначения и медицинской техники.
11. Структурные подразделения услугодателя в соответствии с Правилами экспертизы проводят экспертизу материалов в сроки, установленные пунктом 4 Стандарта.
Ответственный работник структурного подразделения подготавливает и согласовывает с руководителем структурного подразделения сопроводительное письмо и заключение по результатам оказания государственной услуги.
Согласованные проекты сопроводительного письма и заключения по результатам оказания государственной услуги ответственный работник структурного подразделения передает для подписания руководству услугодателя.
12. Руководство услугодателя по завершении экспертизы подписывает сопроводительное письмо и заключение по результатам оказания государственной услуги.
13. Последовательность процедур (действий), взаимодействий структурных подразделений (работников) услугодателя в процессе оказания государственной услуги отражается в справочнике бизнес-процессов оказания государственной услуги согласно приложению 2 к настоящему регламенту.
|
|
Приложение 1 |
Описание последовательности процедур (действий) с указанием длительности каждой процедуры (действия)

|
|
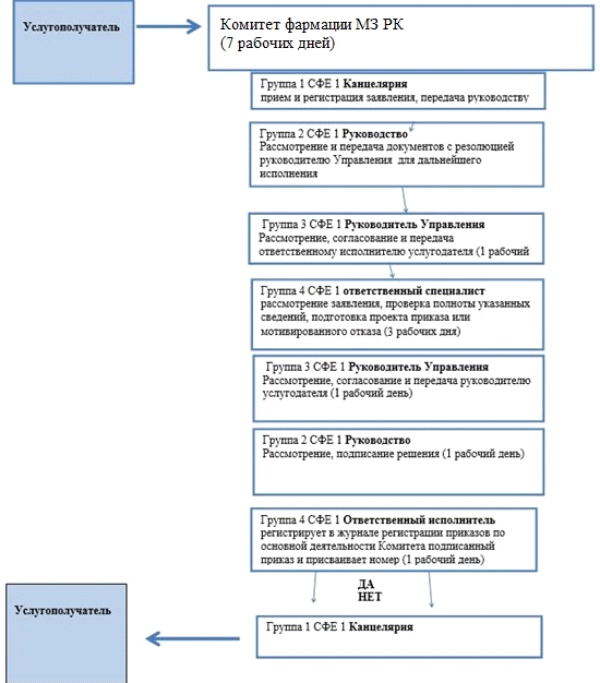
Приложение 2 |
Справочник бизнес-процессов оказания государственной услуги
|
|
Приложение 2 |
|
|
Приложение 7 |
Регламент государственной услуги "Выдача сертификата на фармацевтический продукт"
Глава 1. Общее положения
1. Государственная услуга "Выдача сертификата на фармацевтический продукт" (далее – государственная услуга) оказывается на основании статьи 71 Кодекса Республики Казахстан от 18 сентября 2009 года "О здоровье народа системе здравоохранения", а также согласно Стандарту государственной услуги "Выдача сертификата на фармацевтический продукт", утвержденному приказом Министра здравоохранения и социального развития Республики Казахстан от 28 апреля 2015 года № 293 (зарегистрирован в Реестре государственной регистрации нормативных правовых актов за № 11338) (далее – Стандарт) Комитетом фармации Министерства здравоохранения Республики Казахстан (далее – услугодатель).
2. Прием документов для оказания государственной услуги и выдача результатов оказания государственной услуги осуществляется через канцелярию услугодателя либо через НАО "Государственная корпорация "Правительство для граждан".
3. Форма оказания государственной услуги: бумажная.
4. Результатом оказания государственной услуги является выдача сертификата на фармацевтический продукт, (далее – сертификат) в бумажном и (или) электронном виде по форме согласно приложения 2 Стандарта или мотивированный ответ об отказе в оказании государственной услуги в случаях и по основаниям, предусмотренным пунктом 10 Стандарта.
Глава 2. Описание порядка действий структурных подразделений (работников) услугодателя в процессе оказания государственной услуги
5. Основанием для начала процедуры (действия) по оказанию государственной услуги является получение услугодателем представленных документов услугополучателя, необходимых для оказания государственной услуги. Перечень документов необходимых для оказания государственной услуги при обращении услугополучателя предоставляется согласно пункту 9 Стандарта.
6. Процедуры (действия) процесса оказания государственной услуги:
процесс 1 – сотрудник канцелярии услугодателя в течение 15 мин со дня поступления документов, проводит регистрацию полученных документов, и передает на рассмотрение руководителю услугодателя, при этом в правом нижнем углу заявления проставляется регистрационный штамп на государственном языке с указанием даты поступления и входящего номера;
процесс 2 – руководитель услугодателя в течение 0,25 (2 часа) рабочего дня со дня поступления документов, рассматривает документы услугополучателя и отписывает заместителю руководителя услугодателя;
процесс 3 – заместитель руководителя услугодателя в течение 0,25 (2 часа) рабочего дня со дня поступления документов, рассматривает документы услугополучателя и отписывает руководителю Управления государственных услуг в сфере фармацевтической деятельности и интеграции (далее – Управление);
процесс 4 – руководитель Управления в течение 0,5 (4 часа) рабочего дня со дня получения документов, рассматривает документы услугополучателя на соответствие предъявляемым требованиям и отписывает главному эксперту (эксперту) Управления;
процесс 5 – главный эксперт (эксперт) Управления в течение 2 (двух) рабочих дней со дня получения документов осуществляет рассмотрение документов услугополучателя и направляет их в экспертную организацию с сопроводительным письмом с приложением копии акта последней инспекции производства (или отчет по инспекции производственной площадки за последние три года) для подготовки проекта сертификата на фармацевтический продукт;
процесс 6 – сотрудник экспертной организации в течение 10 (десяти) рабочих дней со дня получения заявления от Комитета проверяет соответствие статуса фармацевтического препарата и статуса организации с данными регистрационного досье, представленного для экспертизы при государственной регистрации, перерегистрации и внесении изменений в регистрационное досье лекарственного препарата. По результатам проверки сотрудник экспертной организации оформляет проект сертификата на фармацевтический продукт и направляет в Комитет с сопроводительнм письмом, подписанным руководителем или уполномоченным лицом экспертной организации;
процесс 7 – главный эксперт (эксперт) Управления в течение 1 (одного) рабочего дня со дня получения проекта сертификата на фармацевтический продукт от экспертной организации готовит сертификат, визирует его уполномоченными лицами услугодателя и предоставляет на подпись руководителю услугодателя;
процесс 8 – руководитель Управления в течение 0,5 (4 часа) рабочего дня подписывает сертификат и передает на подпись руководителю услугодателя;
процесс 9 – руководитель Комитета в течение 0,5 (4 часа) рабочего дня рассматривает, подписывает сертификат и передает главному эксперту (эксперту) Управления;
процесс 10 – главный эксперт (эксперт) Управления в течение 1 (одного) рабочего дня подписанный сертификат регистрирует в журнале регистрации сертификатов услугодателя и присваивает номер.
7. Результат процедуры (действия) по оказанию государственной услуги, служит основанием для начала выполнения следующих процедур (действий):
1) регистрация представленных документов услугопоучателя, необходимых для оказания государственной услуги, в канцелярии услугодателя и передача их руководителю услугодателя;
2) резолюция руководителя услугодателя и его заместителя для рассмотрения руководителю Управления;
3) резолюция руководителя Управления для рассмотрения главному эксперту (эксперту) Управления;
4) направление главным экспертом (экспертом) Управления документов в экспертную организацию;
5) подготовка проекта сертификата главным экспертом (экспертом) Управления;
6) визирование проекта сертификата уполномоченными лицами услугодателя;
7) подписание сертификата руководителем услугодателя;
8) регистрация сертификата и присвоение номера главным экспертом (экспертом) Управления;
9) выдача сертификата.
Глава 3. Описание порядка взаимодействия структурных подразделений (работников) услугодателя в процессе оказания государственной услуги
8. В процессе оказания государственной услуги участвуют следующие структурные подразделения (работники) услугодателя:
1) канцелярия услугодателя;
2) руководство услугодателя;
3) руководитель Управления;
4) главный эксперт (эксперт) Управления.
9. Описание последовательности процедур (действий) между структурными подразделениями (работниками) услугодателя.
Сотрудник канцелярии со дня обращения услугополучателя:
1) проверяет наличие всех представленных документов;
2) регистрирует в журнале регистрации обращений;
3) передает документы руководителю услугодателя.
Руководитель услугодателя и его заместитель в течение рабочего дня, со дня регистрации документа, распределяют поступившие документы, накладывают резолюцию и передают руководителю Управления.
Руководитель управления в течение рабочего дня, со дня регистрации документа, распределяет поступившие документы, накладывает резолюцию и передает главному эксперту (эксперту) Управления.
Главный эксперт (эксперт) Управления:
1) в течение 3 (трех) рабочих дней, со дня регистрации документов, проверяет полноту и соответствие представленных документов;
2) готовит сопроводительное письмо и направляет документы в экспертную организацию (ожидание ответа от экспертной организации 10 рабочих дней);
3) формирует в течение 1 (одного) рабочего дня подготовленный экспертной организацией проект сертификата, визирует его и передает на согласование сертификат.
Руководитель Управления проверяет, визирует проект сертификата в течение 0,5 (4 часа) рабочего дня.
Руководитель услугодателя подписывает сертификат в течение 0,5 (4 часа) рабочего дня.
Главный эксперт (эксперт) Управления в течение 1 (одного) рабочего дня регистрирует в журнале и выдает сертификат, письменно информирует услугополучателя о выдаче сертификата.
10. Последовательность процедур (действий), взаимодействий структурных подразделений (работников) услугодателя в процессе оказания государственной услуги отражается в справочнике бизнес-процессов оказания государственной услуги согласно приложению 7 к настоящему регламенту.
|
|
Приложение 7 |
Справочник бизнес-процессов оказания государственной услуги "Выдача сертификата на фармацевтический продукт"
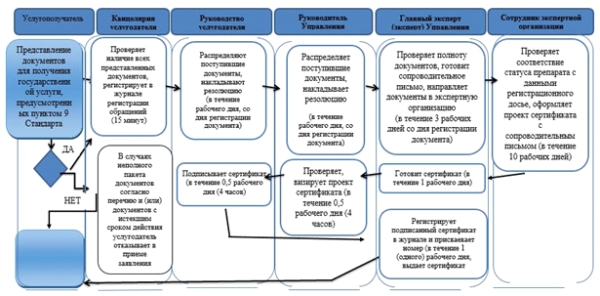
|
|
Приложение 3 |
Схема бизнес-процесса оказания государственной услуги "Выдача согласования и (или) заключения (разрешительного документа) на ввоз (вывоз) зарегистрированных и не зарегистрированных в Республике Казахстан лекарственных средств, изделий медицинского назначения и медицинской техники"
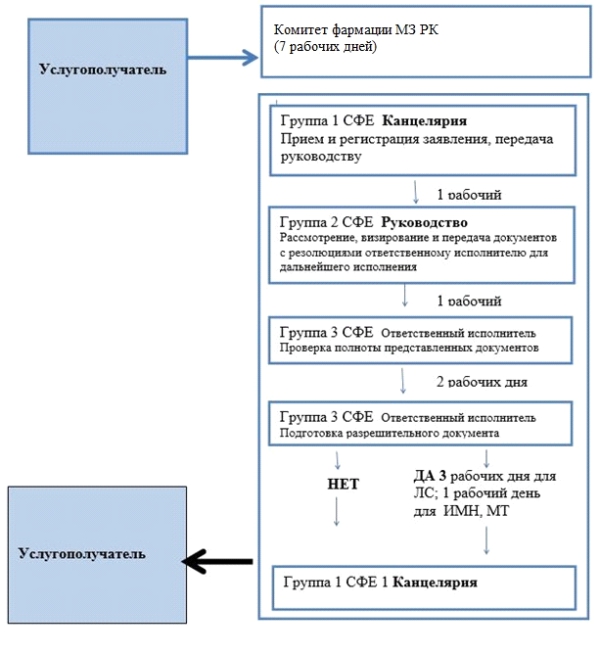
|
|
Приложение 4 |
Схема бизнес-процесса оказания государственной услуги "Выдача разрешения на проведение клинического исследования и (или) испытания фармакологических и лекарственных средств, изделий медицинского назначения и медицинской техники"
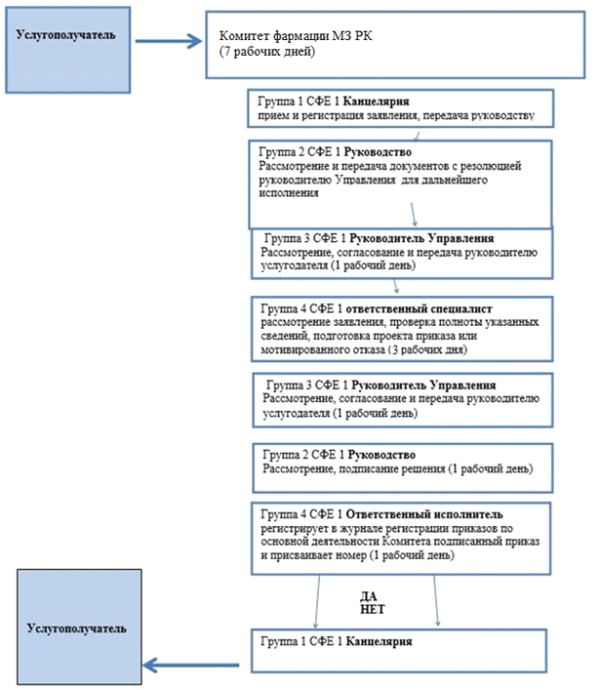
|
|
Приложение 5 |
Схема бизнес-процесса оказания государственной услуги "Государственная регистрация, перерегистрация и внесение изменений в регистрационное досье лекарственных средств, изделий медицинского назначения и медицинской техники"